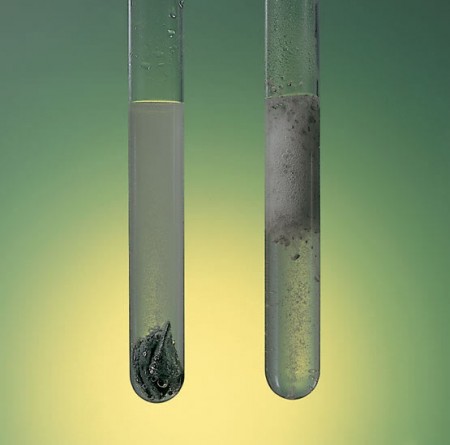
 Khái niệm của tốc độ phản ứng chỉ định lượng chất được chuyển hóa trong một phản ứng nhất định, trên một đơn vị thể tích và thời gian. Do đó, phản ứng của một vật liệu như sắt sẽ chậm hơn nhiều và sẽ mất nhiều năm so với quá trình đốt cháy khí butan, theo yêu cầu của một đám cháy, sẽ xảy ra chỉ trong vài giây.
Khái niệm của tốc độ phản ứng chỉ định lượng chất được chuyển hóa trong một phản ứng nhất định, trên một đơn vị thể tích và thời gian. Do đó, phản ứng của một vật liệu như sắt sẽ chậm hơn nhiều và sẽ mất nhiều năm so với quá trình đốt cháy khí butan, theo yêu cầu của một đám cháy, sẽ xảy ra chỉ trong vài giây.
Trong khi đó, nó sẽ là động học hóa học, khu vực đó trong hóa lý người phụ trách nghiên cứu tốc độ của một phản ứng và cách một số điều kiện biến đổi nhất định làm thay đổi tốc độ phản ứng của một vật liệu hoặc chất, và cả các sự kiện phân tử diễn ra trong phản ứng chung. Trong khi đó, nó sẽ là động lực học hóa học một trong những đề cập đến việc nghiên cứu nguồn gốc của tốc độ của các loại phản ứng khác nhau.
Cần lưu ý rằng các trường như của kỹ thuật hóa học, kỹ thuật môi trường và nghiên cứu áp dụng động học hóa học trong các quá trình của họ.
Có một số yếu tố ảnh hưởng đến tốc độ của phản ứng và cần phải liệt kê để biết chúng ảnh hưởng như thế nào ...
Thiên nhiên của phản ứng là quyết định vì có một số phản ứng mà do bản chất của chúng, có thể nhanh hơn những phản ứng khác và ngược lại. Số lượng các loài phải chịu phản ứng, trạng thái vật lý của các hạt và độ phức tạp của phản ứng là một số vấn đề dẫn đầu trong vấn đề này.
Mặt khác, càng cao thì nồng độ tốc độ phản ứng càng nhanh.
Áp lực, về phần mình, cũng ảnh hưởng đến tốc độ phản ứng. Do đó, tốc độ của các phản ứng ở thể khí tăng lên rõ rệt theo áp suất, điều này thực tế giống như việc tăng nồng độ của chất khí.
Mệnh lệnh của phản ứng cũng phát huy ảnh hưởng của nó vì thứ tự kiểm soát nồng độ ảnh hưởng như thế nào đến tốc độ của phản ứng được đề cập.
Và cuối cùng nhiệt độ Điều quan trọng là vì khi thực hiện phản ứng ở nhiệt độ rất cao sẽ cung cấp nhiều năng lượng hơn cho hệ và do đó tốc độ của phản ứng sẽ tăng lên gây ra sự va chạm của các hạt lớn hơn.